Con người và mọi vật chất đang sống-tồn tại trong hệ trục tọa độ 3 chiều (chiều dài, rộng, cao) Ox, Oy, Oz. Nguyên tử, phân tử, các AO cũng không ngoại lệ.
Orbital nguyên tử, nói đơn giản là ngôi nhà có hình dáng xác định; trong ngôi nhà đó, các electron (nhiều nhất là 2 e) chuyển động hỗn loạn với tốc độ tia chớp-nhanh đến nỗi xuất hiện liên tục tại mọi vị trí trong AO, tạo nên hình ảnh như “đám mây”; bôi dày đặc toàn bộ AO.
Nguyên tắc để electron di chuyển trong 1 AO phù hợp là mức năng lượng nó mang trong người. Cũng giống như bạn, nếu bạn chỉ di chuyển trong vùng không gian là các nhà hàng sang trọng, thì số tiền bạn có rất khủng!
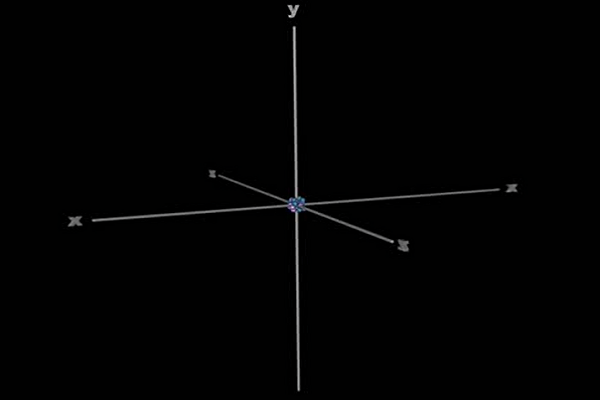
Trong lúc đó, hạt nhân nguyên tử (các hạt p và n) yên vị tại tâm hệ trục tọa độ Oxyz như hình dưới đây:
Electron chuyển động trong 4 loại AO cơ bản sau
Một orbital s (1 ngôi nhà hình s)
AO loại s là 1 khoảng không gian có hình cầu (nhớ phân biệt hình tròn với hình cầu nha bạn). Vì chỉ là 1 khoảng không gian nên AO-s chỉ chứa tối đa 2 electron; hóa học kí hiệu là s2.

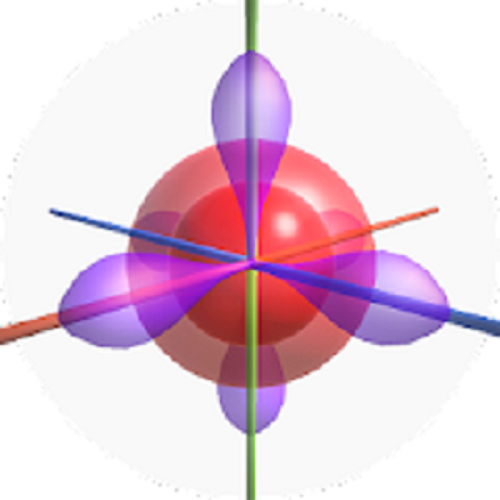
Ba orbital p (3 ngôi nhà hình p)
AO loại p là 3 khoảng không gian có hình số 8 nổi, mỗi AO nằm dọc 1 trục tọa độ Ox, Oy, Oz (bạn có thể tưởng tượng bằng cách lấy 2 quả bóng hình quả lê cột vào nhau; hoặc món thịt xiên que nướng). Vì có đến 3 khoảng không gian nên AO-p chỉ chứa tối đa 6 electron; hóa học kí hiệu là p6.

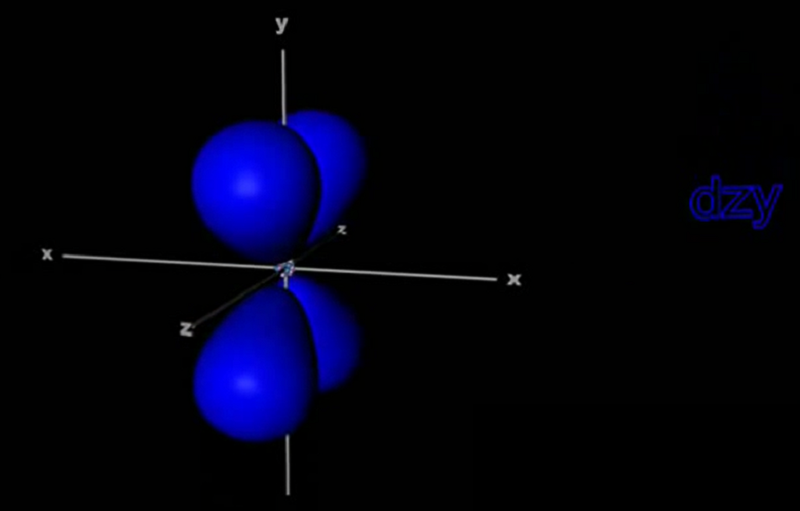
Năm orbital d (5 ngôi nhà hình d)
AO loại d là 5 khoảng không gian có hình rất xinh đẹp (bạn xem hình và tưởng tượng). Vì có đến 5 khoảng không gian nên AO-d chứa tối đa 10 electron; hóa học kí hiệu là d10.




Bảy orbital f (7 ngôi nhà hình f)
Các AO-f quá phức tạp; có 7 AO-f với 7 thể hình khác nhau. Vì có đến 7 khoảng không gian nên AO-f chứa tối đa 14 electron; hóa học kí hiệu là d14.
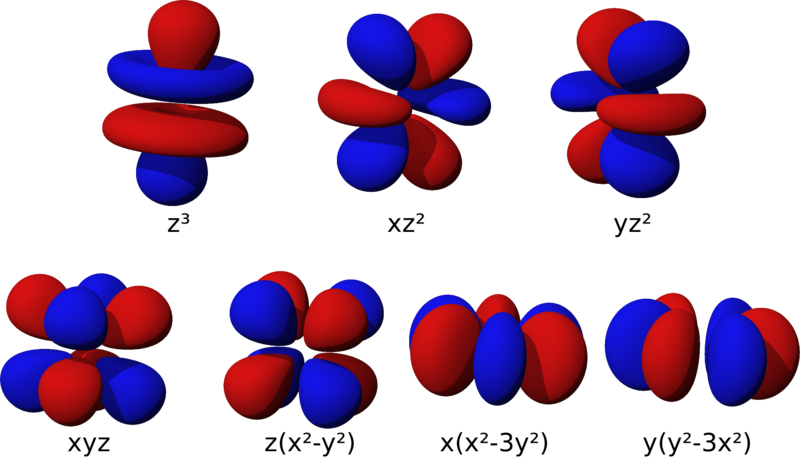
Hình dạng của nguyên tử khi vẽ AO
Nếu gộp các khoảng không gian (các AO) s, p, d trên vào 1 hình, thì hình dạng lớp vỏ nguyên tử lúc này quá khủng khiếp. Trong hình dưới đây, 1 AO-s và 3 AO-p nằm ở bên trong bị che khuất không thấy, hầu như bạn chỉ thấy các 5 AO-d bên ngoài thôi!

Vẽ nguyên tử thế nào cho tuổi teen dễ hiểu?
Ở bài vỡ lòng về nguyên tử, bạn có nhớ hình ảnh trái bắp Mỹ có ruột vàng ươm và nhiều lớp vỏ mảnh mai bên ngoài không? Hình ảnh nguyên tử bạn đã gặp hao hao giống vậy, bởi vì qúa dễ hiểu. Như hình dưới đây, loại nguyên tử Neon có hạt nhân chứa 10p, 10n; vỏ có 2 lớp: lớp trong chứa 2e, lớp ngoài chứa 8e.
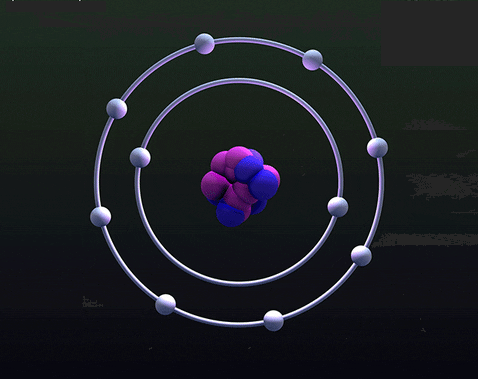
Giờ đây bạn sẽ hiểu, lớp vỏ nguyên tử không phải giống như lớp vỏ trái bắp-tức từng lớp có ịn electron và nằm chồng chập nhau như hình nguyên tử Argon trên.
Trong nguyên tử, các electron di chuyển “búa xua” len lỏi từ vùng ngoài cho đến vùng sát hạt nhân nguyên tử; nhưng giới hạn trong vùng không gian hình dạng xác định (gọi là AO); vậy trong nguyên tử, sẽ có 1AO (như nguyên tử H, He) hoặc có rất nhiều AO chồng chập lên nhau. Như nguyên tử Argon trên, nếu vẽ AO gần đúng bản chất, bạn sẽ có hình sau đây:
- 2e chạy trong 1AO-s hình cầu nhỏ phía trong cùng.
- 2e chạy trong 1AO-s hình cầu lớn hơn như hình.
- 6e chạy trong 3 AO-p hình số tám nổi.
- sau này thay vì nói như trên, bạn sẽ viết dãy gọn gàng như sau: 1s2 2s2 2p6.
Nếu bạn nhìn nguyên tử vẽ kiểu này, chắc có thể ai đó bị hoa mắt chóng mặt; cho nên cách vẽ lớp vỏ electron như vỏ trái bắp nhìn thân thiện với tuổi teen hơn!
